
近日,浙江大学爱丁堡大学联合学院(ZJE)的刘坚研究员与蛋白质组学国家重点实验室的杨晓研究员、华东师大的上海市调控生物学重点实验室李晓涛教授和上海交大附属上海市第一人民医院的宋滇文主任等多个课题组合作在Nature Communications杂志发表题为Loss of Smad4 promotes aggressive lung cancer metastasis by de-repression of PAK3 via miRNA regulation的研究论文。本文通过建立多种转基因小鼠模型和深入的机制研究揭示了SMAD4调控肺癌转移的新机制(非TGFβ依赖性的)和新靶点(SMAD4/miRNA-495/PAK3)。 文章地址:https://www.nature.com/articles/s41467-021-24898-9
肺癌是全世界和中国死亡人数最多的癌症类型1。超过85%的肺癌患者在确诊时存在显性或亚临床转移1。虽然大多数患者进行了积极的局部和全身治疗,但是仍死于肺癌转移引起的相关疾病1。SMAD4是TGF-β信号通路的关键下游转录因子,且在肺癌患者中具有一定比例的突变和蛋白表达降低2,3。虽然刘坚等研究人员在2015年已经报道SMAD4的缺失可以促进肺癌的发生发展及转移3,4,5,但是SMAD4调控肺癌转移的潜在机制尚不清楚。
刘坚等研究人员已发现在小鼠肺部单独敲除SMAD4不会引起细胞增生和肿瘤形成2,6。本研究通过分析TCGA等肺癌临床数据库,发现SMAD4缺失和KRAS突变及P53突变在同一肺癌患者有一定比例的存在。因此,本研究通过构建KrasG12Dp53flox/flox(简称PK)和KrasG12Dp53flox/floxSmad4flox/flox(简称SPK)的侵袭性肺癌小鼠模型用于研究KRAS突变和P53缺失背景下SMAD4对肺癌的作用。本研究发现SPK小鼠模型的肿瘤转移率明显高于PK小鼠。通过分离PK和SPK肺癌细胞并进行转录组分析及细胞迁移等功能性实验,该研究发现SMAD4缺失后能显著上调原癌基因PAK3的mRNA和蛋白表达(图一、第3步),且进一步激活PAK3下游的JNK-JUN通路(图一、第4和5步),从而促进肺癌的转移。与预期不一样的是,SMAD4对PAK3的调控并不受TGFβ生长因子所影响(非TGFβ依赖性的)。进一步的机制研究发现,SMAD4的ChIP-Seq结果显示SMAD4在PAK3的启动子区域无明显结合,且外源高表达SMAD4不能改变PAK3启动子驱动的Luciferase报告基因活性。这暗示了SMAD4对PAK3的负调控不是经过经典的TGFβ依赖性的转录调控机制。已有的研究发现,基因的转录调控不仅受到启动子区间的调控,而且受到基因3’端UTR(非翻译区间)的调控7。本论文的机制实验显示,SMAD4的缺失能够改变PAK3的3’端UTR驱动的Luciferase报告基因活性。考虑到miRNA能够结合到基因的3’端UTR对靶基因进行转录水平的负调控7,因此,本研究提出了一个科学假设:SMAD4可以通过miRNAs来实现对PAK3的转录负调控。通过生物信息学的筛选和功能性实验的验证,本研究发现,SMAD4对PAK3的转录负调控是通过对miR-495和miR-543进行转录正调控而实现的(图一、第1和2步)。临床上,SMAD4和PAK3-JNK-JUN信号通路的负相关性在在一系列的临床样本(对照肺组织,早期肺癌,晚期肺癌,转移肺癌组织)中也得到了验证。这揭示了SMAD4/miRNA-495/PAK3通路有望成为治疗肺癌转移的新靶点。
值得一提的是,该研究不仅揭示了SMAD4通过非经典作用机制(非TGFβ依赖性的)对肺癌转移进行调控,而且通过小鼠体内实验证明了miRNA-495能有效抑制SMAD4缺失诱导的小鼠肺癌转移。RNA药物在临床应用当中最大的一个挑战就是其体内的稳定性8,9。目前mRNA疫苗(Moderna)在新冠肺炎中的成功应用,说明RNA药物稳定性低的困难在临床应用中得到了一定程度上的克服。因此,miRNA-495有望用于治疗肺癌转移。
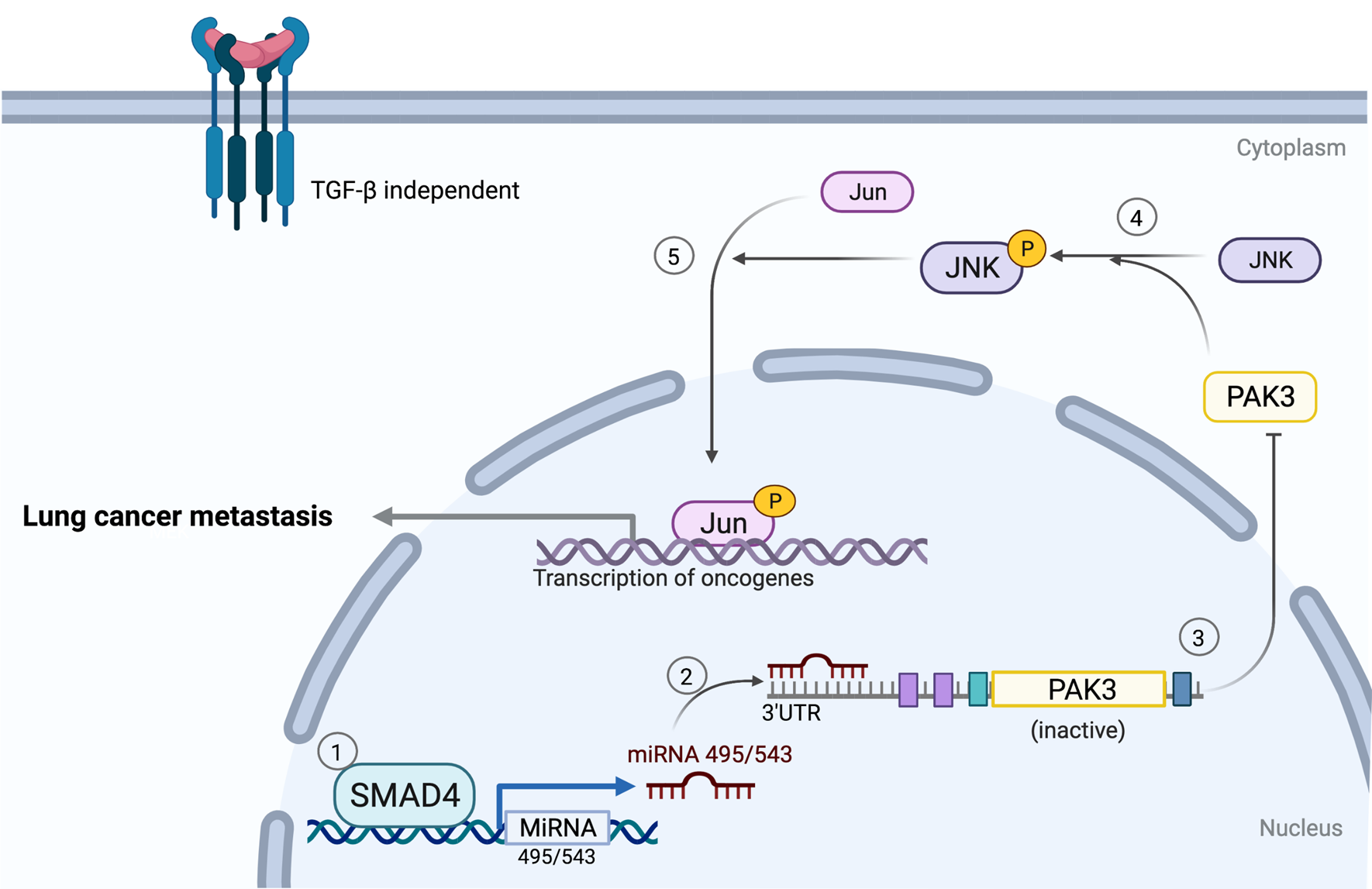
图一、SMAD4抑制肺癌转移的作用机制(非TGFβ依赖性的)
刘坚研究员为该论文的共同通讯作者,ZJE 2020级生物医学专业的硕士生高斐然参与该研究。为了克服研究历程中的些许坎坷(涉及众多转基因小鼠实验、SMAD4非经典作用机制的研究和不同时期肺癌临床样本的收集),各合作课题进行了充分的交流和积极的合作。其中,杨晓课题组主要负责小鼠模型建立等工作;李晓涛和李磊课题组主要负责机制研究和文章撰写等工作;刘坚课题组主要负责生物信息学分析、部分实验设计和整个投稿过程的修订等工作;宋滇文和付俊江课题组主要负责临床样本收集等工作。同时,国际同行为该研究提供了宝贵的建议和支持,包括来自哈佛大学附属医院-麻省总医院肿瘤中心的Nabeel Bardeesy博士及课题组,纽约大学医学院Laura-Isaac Perlmutter肿瘤中心的Kwok-kin Wong博士及课题组,美国贝勒医学院Dan L. Duncan肿瘤中心的Robb E. Moses博士及课题组。
刘坚课题组的网页链接:https://person.zju.edu.cn/liujian
参考文献:
1. Rebecca L Siegel, et al. Cancer statistics, 2019. CA Cancer J Clin (2019).
2. Xiaohong Tan, et al. Loss of Smad4 promotes aggressive lung cancer metastasis by de-repression of PAK3 via miRNA regulation. Nature Communications (2021)
3. Jian Liu. et al. ErbB2 Pathway Activation upon Smad4 Loss Promotes Lung Tumor Growth and Metastasis. Cell Reports (2015).
4. Jian Liu, et al. ERBB2 Regulates MED24 during Cancer Progression in Mice with Pten and Smad4 Deletion in the Pulmonary Epithelium. Cells (2019).
5. Ran You, et al. IL17A regulates tumor latency and metastasis in lung adeno and squamous SQ. 2b and AD. 1 cancer. Cancer immunology research (2018)
6. Jian Liu. et al. JNK1/2 represses Lkb1-deficiency-induced lung squamous cell carcinoma progression. Nature Communications (2019)
7. Yuval Malka. et al. Post-transcriptional 3´-UTR cleavage of mRNA transcripts generates thousands of stable uncapped autonomous RNA fragments. Nature Communications (2017)
8. Ugur Sahin. et al. mRNA-based therapeutics — developing a new class of drugs. Nature Reviews Drug Discovery (2014)
9. Meirav Segal. Et al. Challenges identifying efficacious miRNA therapeutics for cancer. Expert Opinion on Drug Discovery (2020)







