细胞膜作为维持细胞内环境稳态的重要屏障,其完整性常常会受到机械应力、辐射、化学物质、炎症反应和病原体入侵等因素的威胁。破损后的细胞膜能够完成有效的膜修复是细胞存活乃至恢复正常生命活动的前提。迄今的研究发现根据损伤类型、伤口尺寸等,细胞将启动不同的修复机制恢复细胞膜的完整性。由于在体生物学研究的困难性,这些研究多建立在体外细胞的研究模型之上,对于动物体内的研究则鲜有报道。
2022年6月30日,浙江大学徐素宏团队在活体动物细胞膜修复研究方面取得重要进展,国际权威期刊Developmental Cell在线刊登了团队的学术论文“Recruitment of tetraspanin TSP-15 regulates plasma membrane repair in C. elegans epidermis”。该研究利用成年秀丽隐杆线虫表皮损伤模型,发现活体动物单细胞水平参与细胞膜修复的关键蛋白TSP-15,并解析了该种四次跨膜蛋白介导在体大创口细胞膜修复的潜在分子动态调控机制。
团队以秀丽线虫表皮细胞为模型,通过遗传学、转基因标记、快速活体显微成像、基因编辑等技术,研究在体环境下表皮细胞如何感知损伤释放信号调控创伤修复的分子细胞学机理。成年线虫表皮细胞hyp7是在发育最终由多个细胞融合形成的多核细胞,损伤后,为了防止细胞内营养和体液的流失以及线虫的存活,hyp7的伤口修复过程必须快速启动并逐步实现细胞膜结构和功能的重塑。该研究将目光聚焦与广泛分布于细胞膜上的四次跨膜蛋白(Tetraspanins, TSPs)。Tetraspanin是一类保守的四次跨膜蛋白质,其作为细胞膜上的组织者,能够通过侧向富集膜受体蛋白、粘附分子以及胆固醇等形成四次跨膜蛋白富集结构域 TEM(Tetraspanin enriched microdomain),进而参与迁移体形成、细胞迁移、侵袭、细胞粘附以及细胞内运输等过程,能够在一定程度上维持细胞膜的完整性。研究发现TSP-15不仅在成年线虫表皮中表达,而且能够对针刺、激光、单线氧化学损伤、遗传突变所导致的损伤等多种细胞膜损伤方式发生响应,并在伤口处发生明显聚集。另外更重要的是,如果缺少TSP-15,hyp7的修复会明显发生障碍。这些结果表明TSP-15是线虫表皮细胞膜修复所必需的。研究团队提出了TSP-15修复破损细胞膜的模型:TSP-15向伤口处的聚集受到RAB-5,VPS-32.1和VPS-4的调控,TSP-15的聚集能够进一步招募重要的膜修复蛋白SYX-2富集于细胞膜缺损处帮助细胞膜修复,确保损伤后膜结构的完整性。
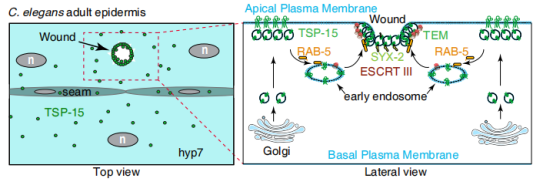
该研究在活体动物体内再次尝试解析单细胞损伤的内源性调控机制,发现了新的关键蛋白以及膜修复蛋白的可能转运途径,并联系了同已知膜修复蛋白之间的互作关系。为今后通过遗传学筛选参与调控细胞膜损伤修复的关键基因奠定了基础,同时也为研究复杂环境下研究细胞损伤内源性修复和再生机制提供了更多可能。
该项研究的共同第一作者之一为浙江大学爱丁堡大学联合学院(ZJE)博士后孟曦男,浙江大学基础医学院博士生王园园、杨庆先为本文共同第一作者。ZJE副院长徐素宏为本文通讯作者。该研究感谢国家重点研发计划、国家自然科学基金委、浙江省自然科学基金等经费的支持。特别感谢清华大学俞立教授,浙江大学刘伟,孙启明教授对该项研究的帮助。
全文链接:
https://www.cell.com/developmental-cell/fulltext/S1534-5807(22)00413-0
课题组介绍
About lab
徐素宏实验室的研究方向主要是聚焦细胞和组织的损伤应激,伤口修复及再生的分子动态调控机制,细胞器感知应激损伤的内源性快速动态变化机理等(https://person.zju.edu.cn/suhongxu)。团队希望有更多热爱基础科学研究、对细胞生物学、生物信息学、组学和组织损伤修复和与再生感兴趣的学生、博士后加入。实验室近期招聘博士后2-3名,技术员1-2名。有意者请发送邮件至shxu@zju.edu.cn。







