放射性物质在现代社会的应用十分广泛,涉及核工业、医学影像与肿瘤放疗等诸多方面。与此同时,在肿瘤放疗与放射性事故中,人体可能受到辐照进而导致放射性损伤的发生,引起一系列急性与慢性症状,甚至导致死亡,严重危害着人们的生命与健康。为预防放射性损伤,开发应有效、便捷的辐射防护剂十分必要。虾青素(Astaxanthin,ASX)是一种天然来源的类胡萝卜素,具有良好的口服安全性和强大的自由基清除能力,可有效防止辐射导致的细胞氧化应激与后续损伤,同时具有抗炎、抗凋亡等作用,是一种颇具潜力的天然辐射防护剂。然而,由于ASX的水溶性与稳定性差、口服利用度低,难以经口服途径实现理想的体内分布,在放射防护中的应用受到了限制。
近日,我院周民课题组针对上述问题设计了一种可高效负载ASX的微藻-纳米复合口服递送系统,用于防护肠道及全身的放射性损伤(图1),该项工作以Oral Microalgae-Nano Integrated System against Radiation-Induced Injury为题发表于ACS Nano。该工作以课题组前期的微藻递送研究为基础,采用可食用的天然微藻---螺旋藻(Spirulina platensis, SP)作为复合递送系统的微载体。由于SP表面具有负电性,因此可以吸附正电荷物质。团队利用了SP的这一天然特性,首先将ASX封装于壳聚糖修饰的正电荷纳米颗粒(ASXnano)中,再使其通过静电吸附作用附着于SP表面,形成均匀致密的纳米涂层(图2A),从而构建了将微藻载体与纳米载体相结合的复合递送系统(SP@ASXnano),该合成方法步骤简易、负载效率高,可有效保持SP与ASX的结构与生物活性。
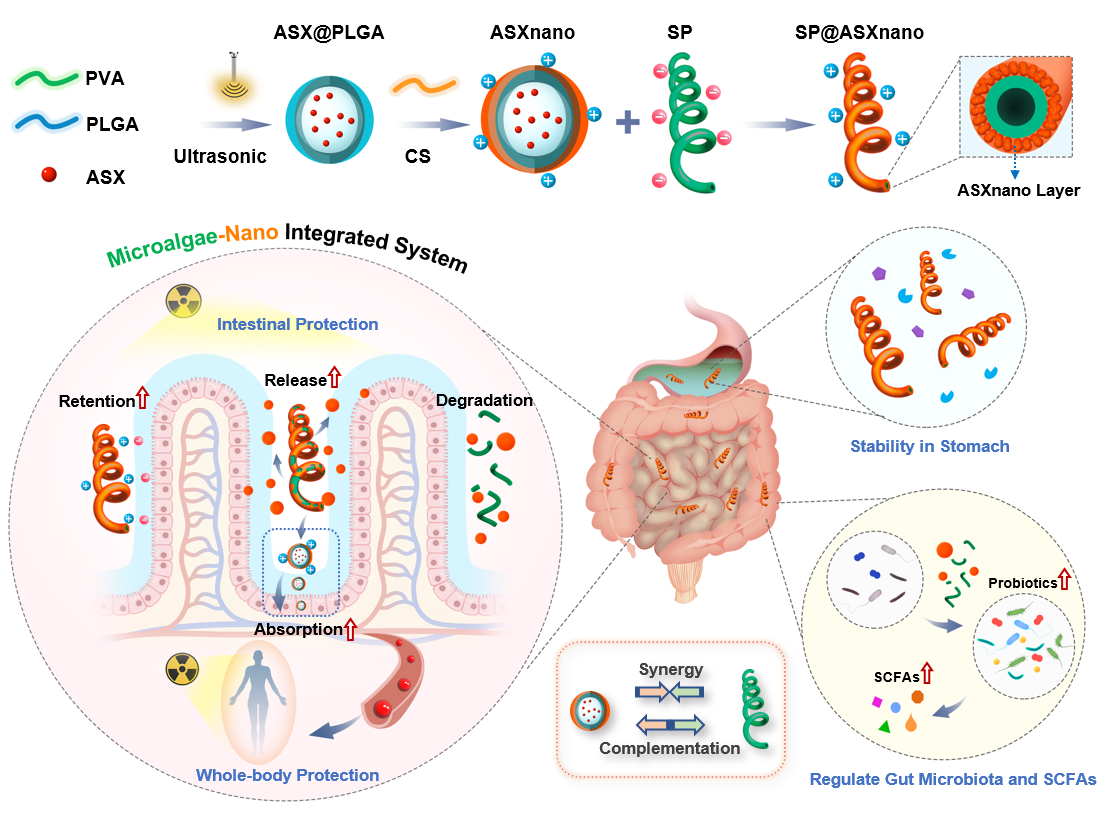
图1 微藻-纳米复合口服递送系统的合成步骤与主要作用机制。PVA,聚乙烯醇;PLGA,聚乳酸-羟基乙酸;ASX,虾青素;CS,壳聚糖;SP,螺旋藻;ROS,活性氧;SCFAs,短链脂肪酸
实验显示,所构建的微藻-纳米复合递送系统具有“既互补又协同”的作用特性,SP与ASXnano之间既具有互为补充的药物递送能力,又具有多方面的协同治疗作用。具体而言,SP微载体具有肠内滞留时间长、分布面积大、易于降解等递送特点,可在肠道内持续、充分地释放ASXnano(图2B);ASXnano纳米载体则可以提高药物水溶性,保护药物活性,促进药物经肠道吸收进入血液循环,从而有效增加肠道与全身的药物浓度,显著改善口服生物利用度。同时,SP和ASXnano在抗炎、保护造血功能、调节肠道菌群、增加粪便SCFAs等方面具有协同效应,可共同增强对放射性损伤的防护效果,发挥多方面的有益作用。
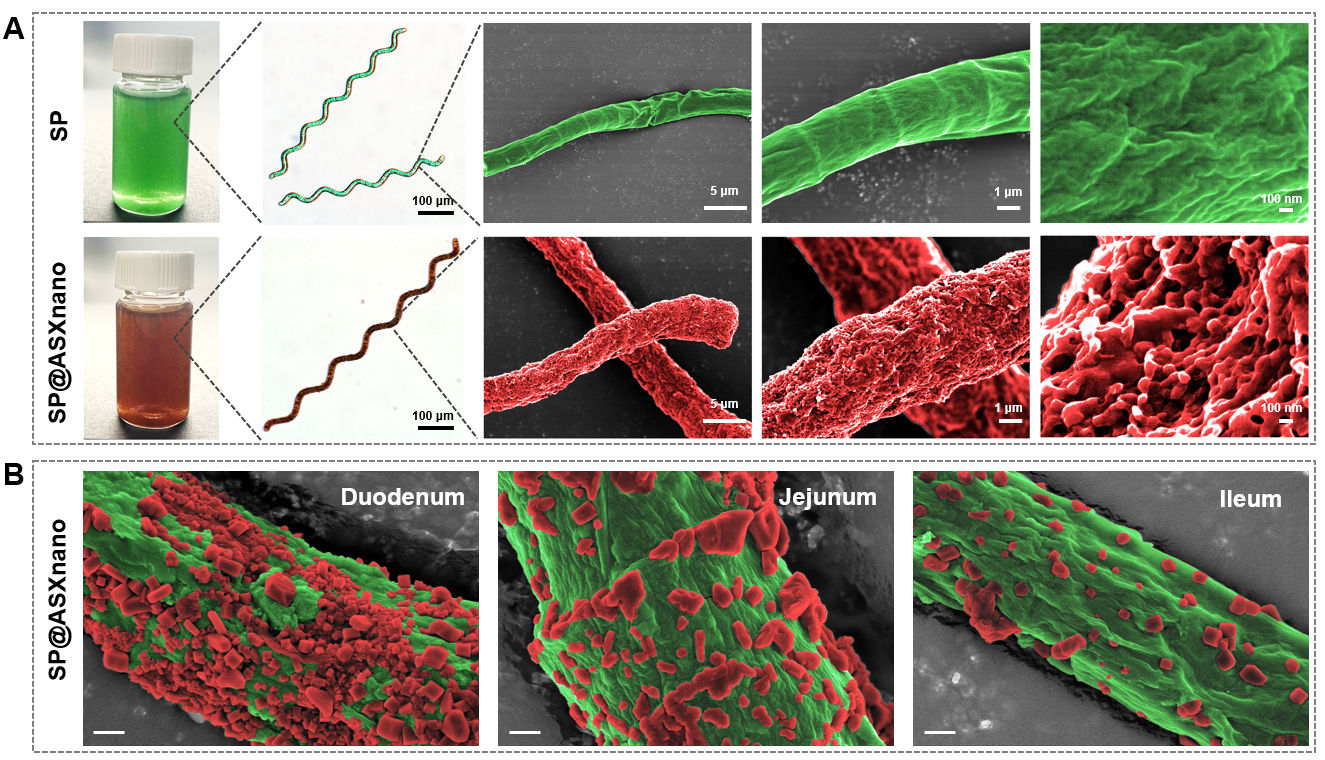
图2(A)SP吸附ASXnano前后的形貌;(B)SP@ASXnano口服后在十二指肠、空肠、回肠部位的形貌
该工作利用天然微藻有效负载了难溶性药物虾青素,实现了该药物在肠道与全身辐射防护中的口服应用,开发了一种具有良好安全性、口服利用度与多重有益效果的口服辐射防护制剂。该研究也揭示了微藻-纳米复合策略在口服递送中的优势,拓展了螺旋藻作为难溶性药物载体的适用性,为口服药物递送和辐射防护研究提供了有潜力的解决方案。上述研究得到了国家重点研发计划、国家自然科学基金、浙江省重点研发计划项目基金、创新研究院医药转化项等基金项目的大力支持。
近年来,我院周民课题组基于微藻活性生物材料在医学应用领域开展了系列创新性研究。前期,周民团队开展了基于工程化微藻用于肿瘤治疗(Science Advances 2020; Advanced Functional Materials 2020; Small 2020; ACS Applied Materials & Interfaces 2020; Theranostics 2021; View 2021);感染疾病治疗(Nano Today 2022; Adv. Therapeutics 2020)、胃肠道炎症(ACS Nano 2023; Nature Communications 2022; Science Advances 2021)等系列研究,并取得了一系列开创性的进展。团队已完成微藻药物小规模化和标准化生产以及相关大动物模型药理和毒理学系统研究,推动其临床转化。
原文链接:
https://doi.org/10.1021/acsnano.3c01502







