肠道微生物菌群是一个庞大复杂的群体,被认为是人体后天获得的一个重要器官,有人体的“第二个大脑”之称。肠道菌群的组成、结构和比例与人类健康状况密切相关。然而,肠道微生物组成的改变可能导致菌群失调,一旦肠道菌群微生态平衡被破坏,将会造成各种胃肠道及全身性疾病。炎症性肠病(Inflammatory bowel disease,IBD)是一种以微生物失调及慢性肠道炎症为特征的胃肠道复发性疾病,影响着全世界数百万人。炎症性肠病的发病机制尚不完全清楚,越来越多的动物研究和临床试验表明,肠道菌群在调节炎症性肠病中起到至关重要的作用。促进肠道有益菌生长,抑制有害菌生长,增加微生物多样性是缓解炎症性肠病的有效策略。
肠道微生物菌群的可塑性使得人为操纵外部影响因素从而重塑肠道微生物结构成为可能。益生菌补充剂具有抑制病原体在肠道定植、保护肠道粘膜屏障等有益作用,是积极调节肠道微生物组平衡的有效策略。益生菌口服输送到肠道微生物组作为一种非侵入性的给药方式受到广泛关注,相较于粪菌移植,口服益生菌具有更高的患者依从性及生物安全性。但由于肠胃道环境复杂、流动性强,导致口服益生菌利用度低、肠道定植受限。因此,如何设计益生菌口服给药载体,提高益生菌在胃肠道的功能特性、存活率及稳定性是利用益生菌平衡肠道微生物组亟待解决的问题。
藻菌共生系统是利用藻类和细菌两类生物之间的生理功能协同作用而形成的天然生态系统。藻类植物通过光合作用利用水中的二氧化碳和氨基等营养物质,合成自身细胞物质并释放出氧气;而细菌则利用水中氧气提供养分生长,产生二氧化碳和上述营养物质,以维持藻类的生长繁殖,形成互补的天然共生微生态系统,工业上广泛应用于污水处理等领域。
浙江大学爱丁堡大学联合学院(ZJE)/浙江大学鄂尔多斯鄂托克生物医药联合研究中心周民教授、钟丹妮博士团队巧妙利用菌藻共生系统原理,经过大量前期研究,刷选出系列可口服的螺旋藻-益生菌复合药物。该系统结合口服食品螺旋藻以及临床应用的益生菌超高安全性优势,利用螺旋藻和益生菌之间互利共生的特点,极大的提供了益生菌在体内有效定植的能力,实现了肠道炎症等疾病显著的缓解作用。该研究发表在国际学术期刊Journal of Nanobiotechnology期刊发表了题为:Breaking barriers: bacterial-microalgae symbiotic systems as a probiotic delivery system的研究论文。
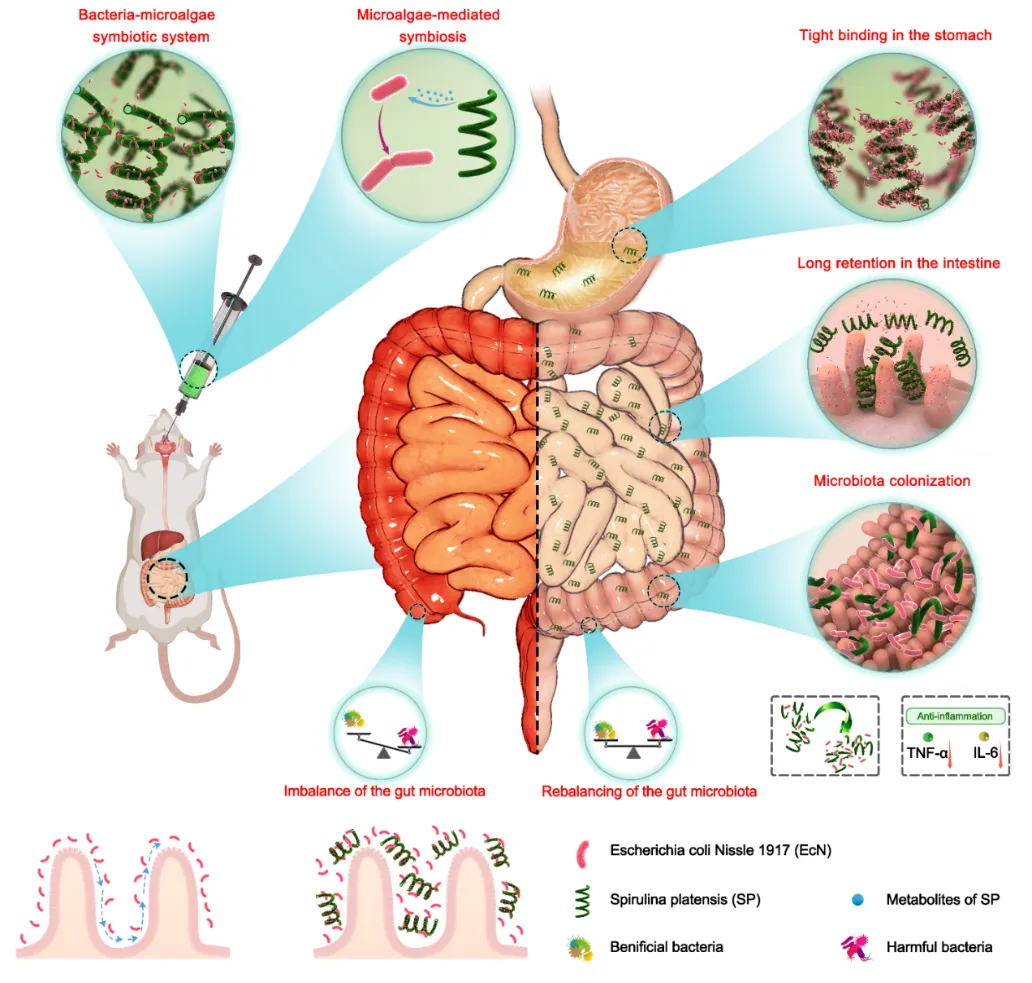
图1 菌藻共生体系EcN-SP实现益生菌定植以及治疗溃疡性肠炎示意图
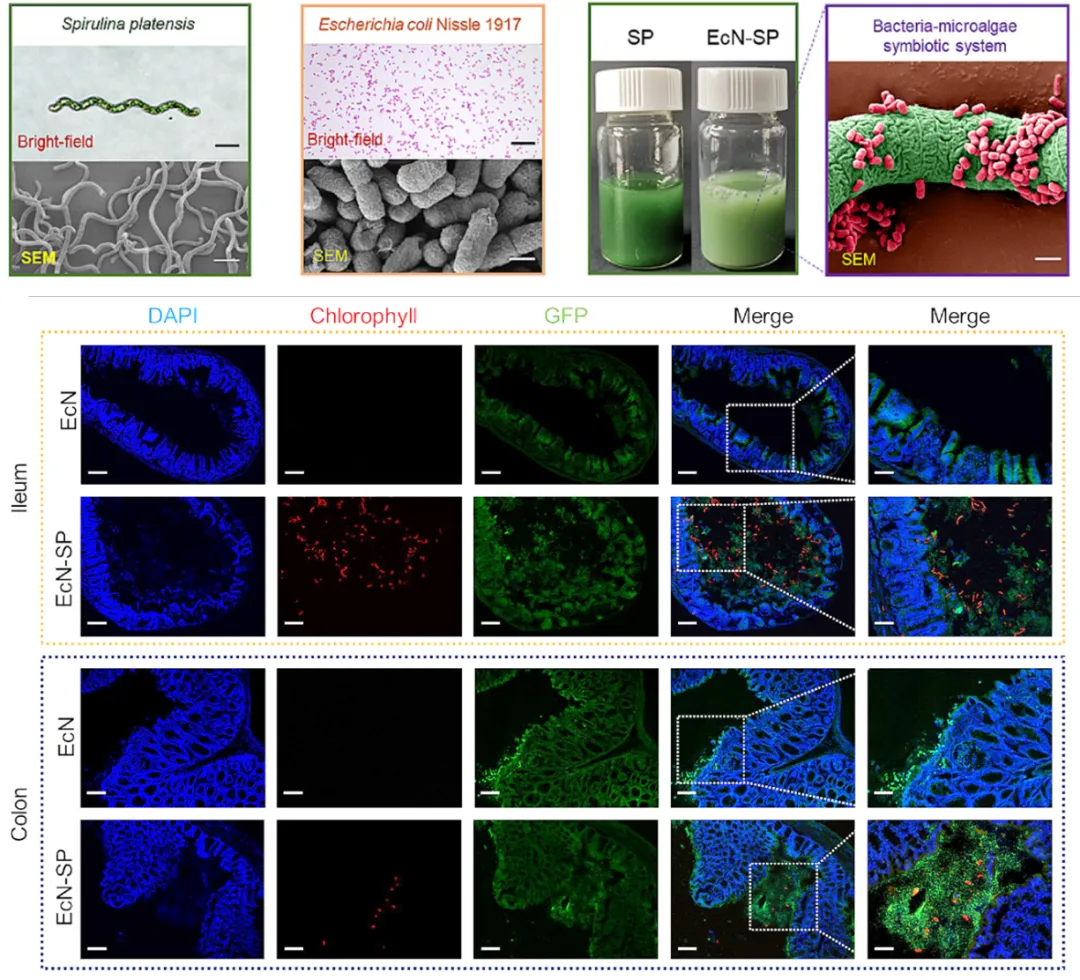
图2 菌藻共生体系可显著提高益生菌体内定植效率
该研究以钝顶螺旋藻(Spirulina platensis, SP)作为益生菌大肠杆菌Nissle 1917(Escherichia coli Nissle 1917, EcN)口服递送载体,构建了一种菌藻共生体系(EcN-SP)用于递送益生菌、促进益生菌在肠道定植及溃疡性结肠炎靶向治疗。螺旋藻作为益生菌口服递送载体具有以下优势:
(1)螺旋藻可作为益生元促进益生菌增殖。菌藻共生体系EcN-SP在肠道递送过程中,益生菌可以在螺旋藻的帮助下不断增殖,有利于益生菌在肠道定植。
(2)螺旋藻可减少益生菌通过胃部的损失。在胃部环境中,螺旋藻与益生菌亲和力增强,有利于帮助益生菌快速过胃,减少益生菌在胃部的损失。在肠道环境中,螺旋藻与益生菌亲和力减弱,有利于益生菌在肠道定植。
(3)螺旋藻可延长益生菌在肠道的滞留时间。螺旋藻载体独特的螺旋结构使其更易于嵌入肠道绒毛中,与其共同递送的益生菌可以在其帮助下延长在肠道组织中的滞留时间,从而提高肠炎的治疗效果。(4)螺旋藻可协同益生菌预防和治疗部分肠道疾病。螺旋藻具有抗炎、抗氧化等诸多医疗功能,能有效降低肠道细胞IEC-6中活性氧的积累,降低活性氧对细胞DNA造成的氧化性损伤,并维持细胞的增殖活性,可协同益生菌治疗溃疡性肠炎。

图3 菌藻共生体系对溃疡性结肠炎小鼠有较好的治疗效果
在小鼠溃疡性结肠炎模型中,菌藻共生体系可以通过维持肠道的结构和完整性,下调肠道组织中促炎因子TNF-α和IL-6的表达,减轻炎症性肠病的炎症反应,有效治疗溃疡性结肠炎。此外,菌藻共生体系可以调节肠道菌群,增加有益菌的相对丰度,减少有害菌的相对丰度,从而维持肠道微生态平衡。菌藻共生体系采用简单的混合方式构建,未引入任何额外的化学试剂及复杂的合成过程,确保了其生物安全性,为后续临床转化及商品化过程提供了有力保障。
浙江大学黄慧博士后为该论文的第一作者。ZJE周民教授和浙江大学钟丹妮为该论文的共同通讯作者。上述研究得到了国家重点研发计划项目、国家自然科学基金、浙江省重点研发计划项目等基金项目的大力支持。
论文链接:
https://doi.org/10.1186/s12951-024-02647-6







