放射治疗是肿瘤临床治疗的主要方法之一,特别是对于局部肿瘤的限制或不可切除肿瘤的根除。然而,其疗效受到肿瘤周围健康组织的毒性损伤和肿瘤放射耐性的限制。为了应对这一困境,增强肿瘤的放射敏感性是一种理想的策略,可以通过使用更低的辐射剂量来有效杀伤肿瘤细胞,从而减少对其他健康组织的毒性损伤。肿瘤放射耐性的一个重要机制包括肿瘤的乏氧微环境和高谷胱甘肽含量,两者减少了辐射产生的活性氧自由基的数量,减轻了肿瘤细胞的DNA损伤,从而使肿瘤细胞对放疗产生耐性。大多数目前临床常用放射增敏剂,如硝基咪唑,通过影响单一途径发挥作用,容易产生耐药性,并且通常伴有较大的全身毒性。因此,设计多种途径协同发挥作用的放疗增敏体系是一大挑战。
具有光合作用能力的微生物能够以较低的成本有效地利用太阳能,在可再生能源和环境保护领域得到了广泛的应用。比单纯的微生物,将微生物体内的酶与无机材料相结合可以获得更高的光合效率。然而,酶的催化作用往往依赖于特殊的环境和其他蛋白质和细胞器的协同作用,无机材料直接结合会导致稳定性差等一系列问题。全细胞无机生物杂化体系,由完整细胞和无机材料偶联而成,对催化环境要求低,可长期稳定生产,进一步拓展了其潜在的应用前景,然而其目前在医学领域的应用探索尚不完善,有待进一步的开发。
近日,浙江大学爱丁堡联合学院(ZJE)周民教授团队通过与浙江大学医学院王凯教授团队合作,在全细胞无机生物杂化系统的抗肿瘤应用上取得新进展,在国际学术期刊Journal of Nanobiotechnology期刊发表了题为:Photosynthetic bacteria-based whole-cell inorganic-biohybrid system for multimodal enhanced tumor radiotherapy的研究论文。该研究工作开发了一种基于微藻的新型肿瘤放疗增敏策略,利用螺旋藻生物系统负载金纳米团簇,通过多角度多途径增强肿瘤的放疗敏感性,在小鼠肿瘤模型上取得了良好的治疗效果。
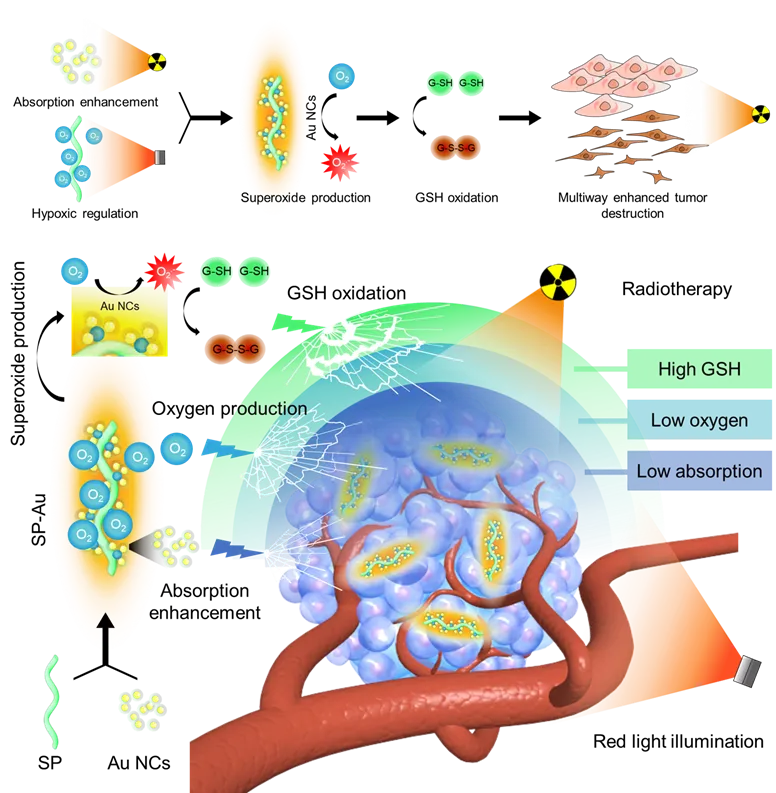
微藻是一种在自然界广泛分布的微生物,具有天然的光合作用能力,在光源照射下能够有效地产生氧气。研究结果表明,利用工程化光合微藻系统可以有效改善肿瘤内乏氧,从而提高放射治疗的抗肿瘤疗效。另一方面,金纳米团簇(Au NCs)由于其功能性和生物相容性,近年来在生物医学应用方面得到了广泛的研究。具有高Z值(Z = 79)和高衰减系数的Au NCs可以显著增强肿瘤组织对辐射能量的吸收。有趣的是,Au NCs还可以通过电子转移将氧气转化为超氧阴离子(•O2−),相比于II型ROS对深层乏氧肿瘤细胞DNA的损伤作用更强,与放疗产生协同作用。
综上,本文设计了一种基于螺旋藻和Au NCs的全细胞无机生物杂交系统(SP-Au),通过以下多种机制协同增强放疗效果:
(1) 在红光照射下产生氧气,缓解肿瘤内的乏氧微环境;
(2) 利用氧气进一步产生ROS自由基(•O2−),消耗肿瘤内GSH含量并杀伤肿瘤细胞;
(3) 金纳米簇能够有效增加肿瘤部位吸收的辐射剂量,增强放疗效果。
SP-Au在A549肺癌模型和小鼠4T1乳腺癌模型中的体内抗肿瘤结果表明,瘤内和静脉注射SP-Au均能够在多种途径的协同作用下有效增强放疗效果。此外,SP-Au在注射后能够被迅速代谢并排出体外,具有良好的生物相容性。因这些结果表明,SP-Au作为一种基于全细胞无机生物杂交体系的放射增敏剂具有良好的抗肿瘤应用前景,可以同时通过多种途径协同增强放射治疗的效果,从而有效杀伤肿瘤细胞。
ZJE周民团队博士生华诗远是论文的第一作者,浙江大学医学院附属第四医院王凯教授,与ZJE周民教授为论文的共同通讯作者。
论文链接:
https://doi.org/10.1186/s12951-024-02654-7







