癌症,这个让无数人闻风丧色的疾病,其实是一场发生在人体内部的“基因战争”。细胞内的基因突变逐步发生、逐渐积累,导致细胞失去正常的生长和分裂控制,进而影响着癌症的发生、发展和维持、扩散与转移。
研究基因组突变不仅可以帮助我们更好地理解癌症的生物学机制,还可以为开发新的治疗方法提供重要线索。科学家们一直在研究这些突变,希望找到战胜癌症的突破口。
这项研究发现了同义突变与表观转录组的直接联系,揭示了一种全新的肿瘤发生发展调控机制,为肿瘤的精准医疗和靶向用药提供了新思路。此外,这个发现也拓展了我们对于分子生物学“中心法则”的理解——基因组DNA序列可以通过直接影响mRNA修饰实现精细调控。

论文截图
论文链接:
https://www.cell.com/cell/fulltext/S0092-8674(25)00095-9
基因突变这个概念大家不陌生,其中那些能够促进癌症发展的基因突变则被成为“驱动突变”。如果说基因是一本复杂的“生命之书”,那么基因突变就好比是书中的“错误”:有些是“错别字”,有些是“段落排序错误”,或许还有些是“段落的疏漏”。有时候,这些错误并不影响“阅读”,但也有时候,这些“错误”会让“生命之书”的故事走向发生巨大变化。
其中,点突变(单个碱基的变化),是一种在癌症中非常常见且十分关键的驱动突变类型。根据已有的研究显示,单个肿瘤通常会获得2到8个驱动突变,这其中大多数是点突变。
在这些点突变中,有一种突变叫“同义突变”,占比不低,大约有25-30%。它不会改变蛋白质的氨基酸序列,从表面上看,似乎对蛋白质的功能没有任何影响,和肿瘤的发生关系不大。
这时,一种发生在RNA分子上的化学修饰引起了团队的关注——表观转录组修饰。这些修饰不改变RNA的核苷酸序列,但可以影响RNA的结构、稳定性和功能。近年来的大量研究表明,表观转录组修饰,尤其是RNA的N6-甲基腺苷(m6A)修饰,在癌症的发生和发展中发挥关键作用。例如,m6A修饰的异常在急性髓系白血病和胶质母细胞瘤中都有发现。
根据这些线索,研究团队猜测,癌症细胞积累的看似“无害”的同义突变,或许和“表观转录组修饰”之间存在着一条没有被发现的链条。
2022年10月,实验室正式启动了该项目。
首先,他们通过最新的COSMIC数据库与TCGA数据,对人类泛癌基因组突变进行了系统的质控与梳理,同时收集整理了最新的人类m6A数据(m6A-Atlas v2.0和REPIC数据库等)。通过三种严格的筛选过滤标准(图1,包括突变可重复性筛选,满足m6A数据覆盖,以及更进一步的可靠性筛选),最终得到了12,849个潜在的m6A Disruption Mutations(破坏性突变),简称m6A-DMs。这些突变可以进一步分为同义突变(sm6A-DM)和错义突变(mm6A-DM)。
他们发现,其中的同义突变(sm6A-DM)更容易发生在抑癌基因(tumor suppressor gene)中。抑癌基因抑制着细胞的异常增殖,一旦这些基因发生突变或功能丧失时,细胞可能会失去对增殖的控制,从而导致肿瘤的形成。
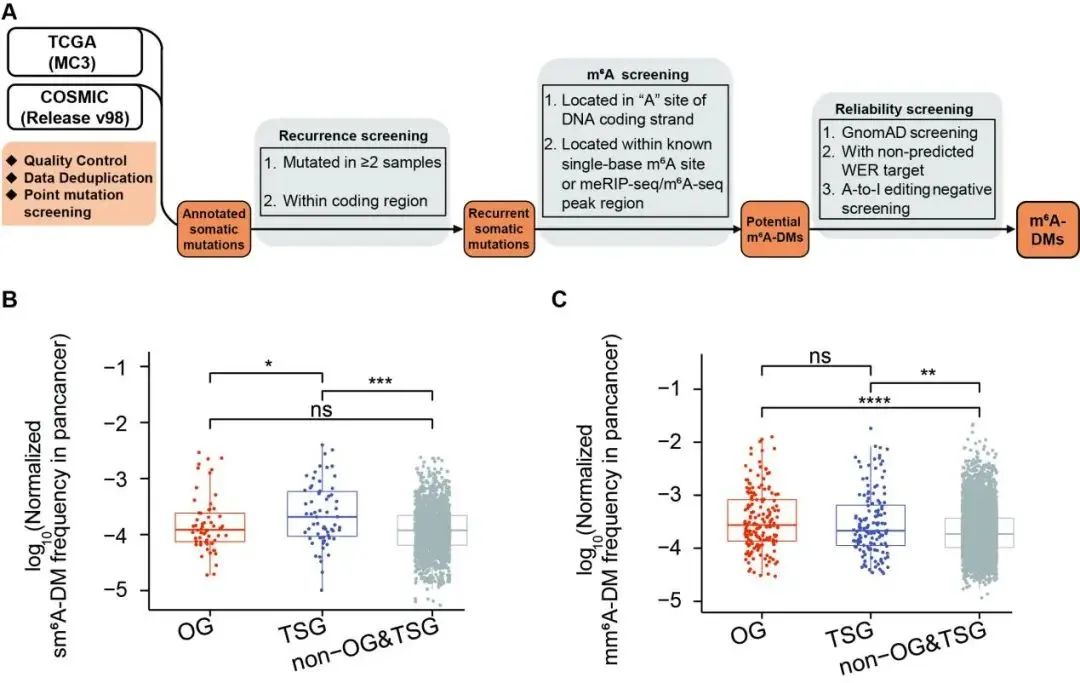
图1. m6A-DM的鉴定流程与基因分布特征
随后,根据分析癌症基因组突变的发生频率,研究人员在一万多个潜在破坏性突变中找到了两个排名最靠前的sm6A-DM位点(CDKN2A-c.A294B和BRCA2-c.A1365G),对其展开了功能验证与机理探究。
他们采用了实验室前期开发的调控手段(dCasRx定点甲基化编辑系统)并结合基因敲入定点突变技术,分别在表观转录组修饰水平和基因组原位水平对高度关联的肿瘤类型细胞进行调控。实验结果表明,这两个位点的m6A修饰水平与对应基因转录本的丰度呈现正相关,也就是说,当这些位点的m6A修饰水平较高时,对应的mRNA数量也较多;反之,当这些位点的m6A修饰水平较低时,对应的mRNA数量也较少。当该位点的发生突变后,会破环该位点的m6A修饰并影响mRNA稳定性,进而导致其相应基因的mRNA数量减少,影响基因的表达水平(图2)。
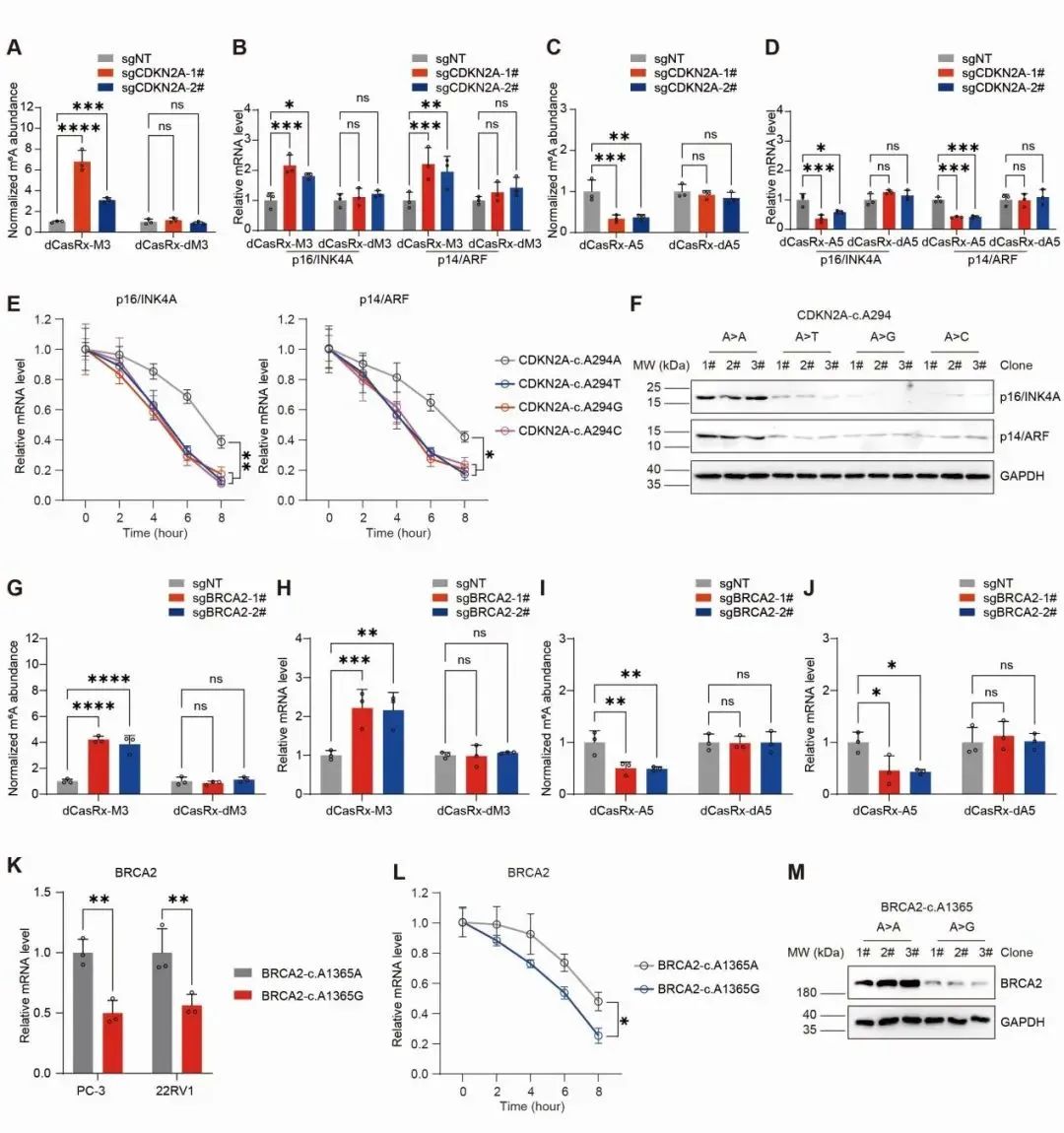
图2. sm6A-DM对mRNA稳定性的显著影响
回到我们最初的话题,这些发现与癌症的发生发展有什么关系?上文提到表观转录组修饰在肿瘤的发生发展中发挥关键作用,同义突变既然可以影响表观转录组修饰,那么,或许同样会影响肿瘤的发生发展。
经过实验分析,研究团队发现,其中一个位点CDKN2A-c.A294B突变导致CDKN2A转录本以及蛋白水平丰度显著下调后,加速了肿瘤细胞的分裂周期,从而增强了肿瘤细胞增殖以及在小鼠体内的成瘤速度,大大增加了该肿瘤的恶性程度。
至此,一条全新的肿瘤发生发展的调控机制已然明晰——sm6A-DMs基因组同义突变能扰乱mRNA的正常m6A修饰,使得mRNA稳定性减弱,引起mRNA和蛋白丰度水平的改变,并改变肿瘤发生发展进程。
原来,同义突变并非全然“无害”!
基于科学研究的严谨性,团队将以上结果进一步向前推进——临床上有一款抑制剂奥拉帕尼(Olaparib),已经获得了FDA批准,被用于治疗BRCA1和BRCA2缺陷的肿瘤。研究团队设计了一组实验,期望验证他们的发现对于肿瘤诊断和治疗的作用。实验结果如他们所料,具有BRCA2-c.A1365G突变的肿瘤细胞对PARPi药物Olaparib治疗更为敏感,在对具有该sm6A-DM突变的荷瘤小鼠采用Olaparib治疗后,肿瘤生长也得到了很好的抑制。这一发现为肿瘤的精准医疗和靶向用药提供了新的思路。未来,或许会诞生更多针对sm6A-DMs的检测和靶向治疗,可以更精准地识别和治疗特定类型的癌症。
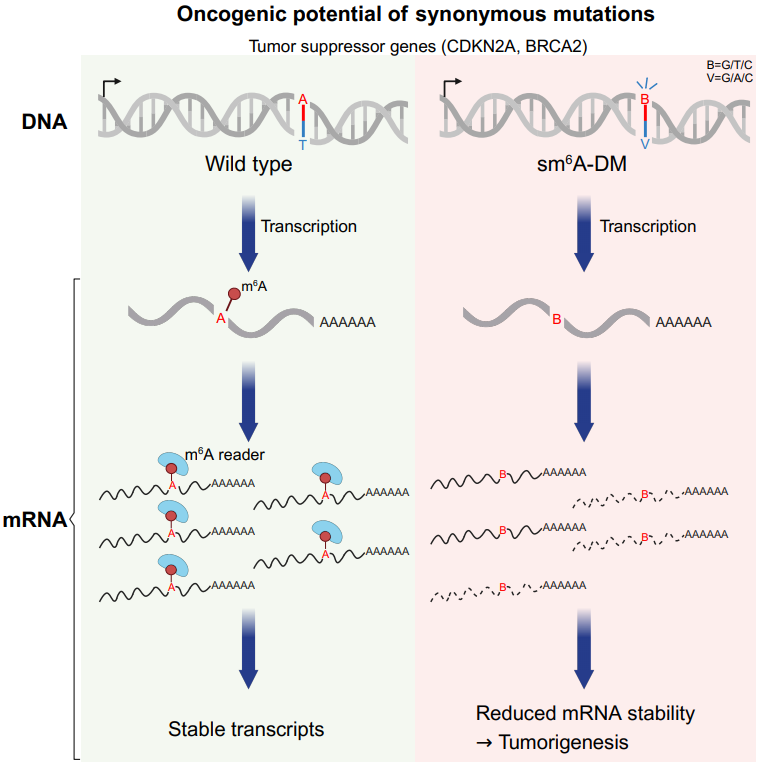
图3. sm6A-DM在肿瘤发生发展过程中所扮演的角色
除此之外,这项研究还有一个更重要的意义,揭示了分子生物学中心法则的一个先前未被重视的维度:DNA突变可以直接决定mRNA的修饰模式。我们都熟悉的“中心法则”认为,DNA的信息通过转录生成mRNA,再通过翻译生成蛋白质。而这项研究则进一步拓展了这一法则,指出DNA突变可以直接影响mRNA的修饰,进而精细调控基因的表达,从而丰富了我们对生命本质的理解。
浙江大学爱丁堡大学联合学院研究员陈迪博士、西湖实验室研究员谢琦博士以及窦岩梅博士为本研究的共同通讯作者。浙江大学爱丁堡大学联合学院博士生邵奇哲和谢琦团队助理研究员蓝一恒和博士生夏真为本文的共同第一作者。本研究得到了国家自然科学基金、科技创新2030重大项目、浙江省“尖兵”和“领雁”研发计划和西湖教育基金会的资金支持。







