生殖细胞是传递遗传信息的关键细胞,决定了有性生殖和物种延续。在人类胚胎发育过程中,最早出现的生殖细胞是原始生殖细胞(PGCs),它们大约在受精后两周从胚胎细胞中特化出来,并伴随着胚胎发育建立生殖系。然而,关于人类PGC发育的精确机制仍不清楚,且其异常可能导致不孕、肿瘤或出生缺陷。RNA结合蛋白(RBP)在调控基因表达方面至关重要,尤其是在生殖细胞发育中。虽然不同物种的生殖细胞命运受到RBP调控的影响,但在人原始生殖细胞特化中的具体作用仍未明确。
2025年5月23日,Nature Communications在线发表了浙江大学爱丁堡大学联合学院陈迪课题组和爱丁堡大学Matthew Brook课题组关于RNA结合蛋白调控人原始生殖细胞命运的最新研究进展。研究表明,DND1和NANOS3是关键的转录后抑制因子,它们共同维持了体细胞和生殖细胞之间的平衡。这一发现为生殖医学疾病的筛查和治疗开辟了新的方向。

论文链接:https://www.nature.com/articles/s41467-025-57490-6#Sec10
DND1作为典型的生殖细胞特异性RNA结合蛋白,已有大量模式生物的研究,但其在人类原始生殖细胞(hPGC)特化中的作用机制仍未明确。通过基因敲除和体外诱导实验,研究团队发现DND1限制了hPGC样细胞(hPGCLCs)的特化。进一步研究发现RNA结合蛋白NANOS3是DND1潜在的互作蛋白,其敲除也导致生殖细胞比例的增加,表明DND1与NANOS3作为复合体共同调控生殖细胞命运。
为了进一步解析其作用机制,研究团队采用了创新的iTRIBE技术,首次在生殖细胞背景下鉴定了DND1和NANOS3的RNA靶标。结果显示,DND1和NANOS3的结合基序高度相似,共享约40%的靶标,这些靶标与hPGCLC特化过程中关键的Wnt信号通路相关。研究团队还通过TRIBE-STAMP技术,确定了SOX4 mRNA是最关键的靶标之一,并揭示了DND1-NANOS3复合体如何通过SOX4调控hPGCLC特化。尽管SOX4的mRNA水平在不同实验组中没有变化,但DND1-NANOS3复合体显著抑制了SOX4的蛋白水平。进一步研究发现,DND1通过招募NANOS3进入加工体(P小体),在P小体内共同抑制SOX4的翻译。
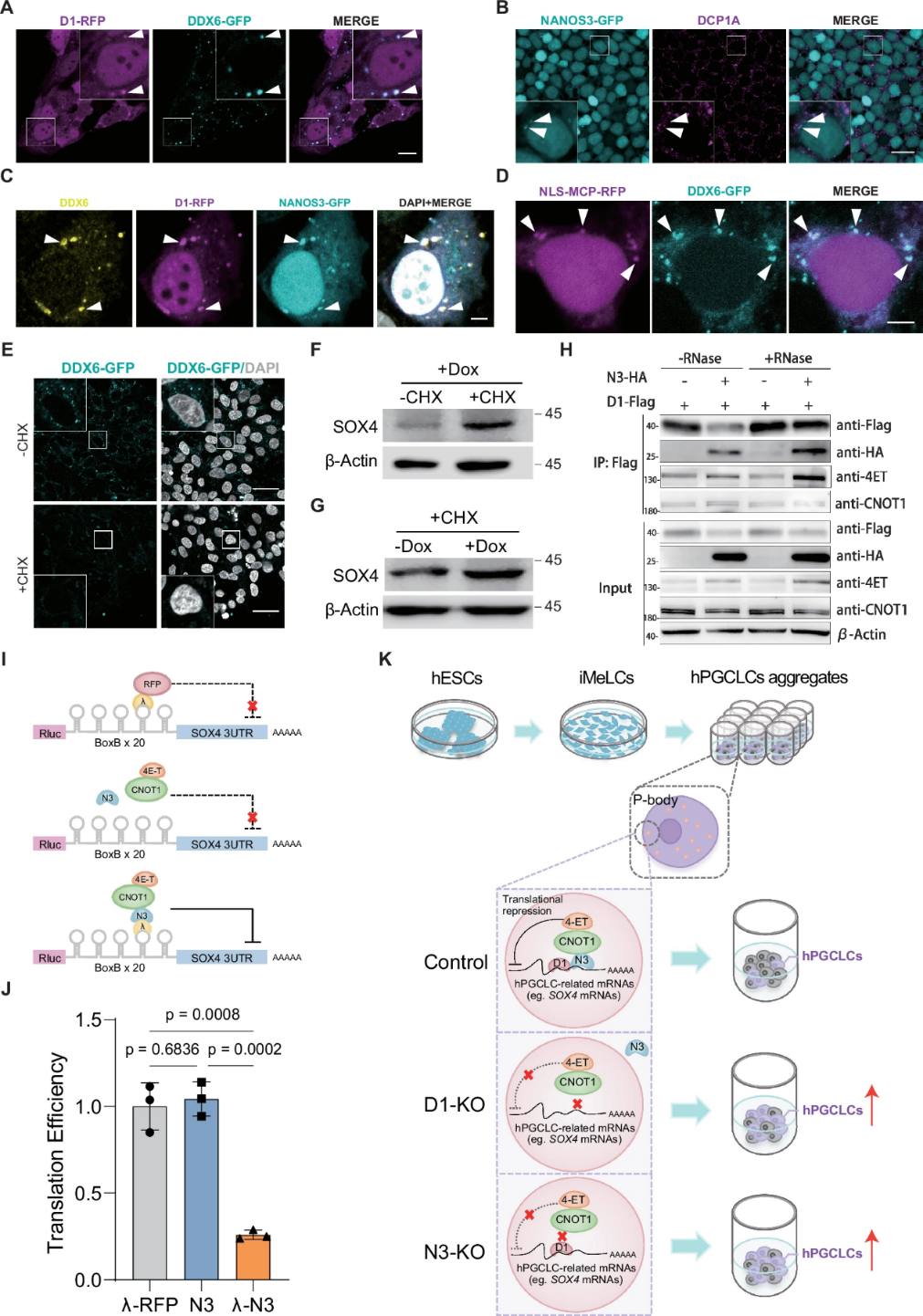
这项研究首次揭示了DND1和NANOS3复合体在抑制人类原始生殖细胞特化中的关键作用,并深入解析了其分子机制。研究表明,DND1-NANOS3复合体是生殖细胞谱系进入的关键“刹车系统”,在早期胚胎发育过程中平衡细胞命运分配。未来,识别更多类似的抑制因子将有助于深入理解生殖细胞与体细胞之间的平衡如何协调,以及这一平衡的破坏如何导致生育相关疾病和出生缺陷。

浙江大学爱丁堡大学联合学院2020级博士生王梓琦和喻弘霖为本文的共同第一作者,浙江大学爱丁堡大学联合学院陈迪研究员和爱丁堡大学Matthew Brook博士为本研究的共同通讯作者。该研究得到了国家自然科学基金、浙江省自然科学基金以及科技部重点研发计划的资金支持。同时感谢浙江大学爱丁堡大学联合学院公共技术平台的技术支持。







