社会不断发展过程中,却伴随着生育力的下降。许多国家都面临生育率低的问题,导致老龄化加剧、劳动力短缺和社会保障压力增大。研究生殖细胞谱系的建立是解决生育力问题的关键。原始生殖细胞(Primordial germ cell, PGC)是生殖细胞的前体细胞,在发育、迁移和分化过程中出现的遗传或表观遗传异常逐步积累将导致配子形成障碍或功能缺陷,进而影响着生育能力的建立、维持和胚胎的正常发育。研究原始生殖细胞的发育机制不仅帮助我们更深入地理解人生殖系统建立的生物学过程,还为开发新的辅助生殖技术提供关键依据。科学家们一直在探索这些细胞的发育规律,希望找到解决生育力问题的新途径。
2025年5月27日,浙江大学爱丁堡大学联合学院陈迪团队、中山大学肿瘤防治中心黄慧琳团队及浙江大学医学院梁洪青团队合作,在Cell Stem Cell杂志上发表了一项重要研究成果。该研究利用三维诱导分化体系技术,成功将人胚胎干细胞(human embryonic stem cell, hESC)分化为原始生殖细胞样细胞(hPGC-like cell, hPGCLC),并首次揭示m6A修饰通过负向调控机制抑制体细胞向生殖细胞的转化。研究团队鉴定出一条关键分子通路——m6A-IGF2BP1-OTX2-MacroH2A.1-TFAP2C调控轴,为理解人类生殖细胞发育提供了新的研究思路。

表观转录组调控,尤其是mRNA分子上的N6-甲基腺苷(m6A)动态修饰,在生殖细胞谱系特化和发育过程中起着核心调控作用。在细胞内,m6A修饰主要由三类蛋白调控:“编码器”蛋白(writer,即m6A甲基化转移酶)负责将甲基基团添加到RNA上;“消码器”蛋白(eraser,即m6A去甲基化酶)负责去除RNA上的甲基化修饰;“读码器”蛋白(reader,即m6A结合蛋白和识别蛋白)则识别RNA上的m6A修饰并介导下游功能反应。因此,m6A修饰是一个动态可逆的过程,通过编码器、消码器和读码器的协同作用,影响细胞命运决定,包括生殖细胞发育的各个阶段。不同的读码器蛋白结合m6A修饰的mRNA将导致不同的命运改变,因此,深入解析m6A读码器蛋白的功能是理解m6A所携带的表观遗传信息如何被解读的重要切入点。
研究团队通过CRISPRi筛选读码器蛋白IGF2BP1在抑制生殖细胞过度分化中扮演了“刹车”角色——当IGF2BP1被敲降时,生成的hPGCLC数量显著上升。为了揭示m6A修饰和IGF2BP1如何“踩刹车”阻止原始生殖细胞过度发育,研究团队进行了多组学数据分析,找到了读码器蛋白IGF2BP1结合的靶点mRNA---OTX2。敲除OTX2或IGF2BP1均可导致hPGCLC数量激增,而在IGF2BP1缺失背景下回补OTX2,则可恢复生殖细胞数量至正常水平。更进一步的,OTX2缺失与MacroH2A.1敲低表型相似,而TFAP2C缺失显著抑制hPGCLC生成。OTX2与TFAP2C双敲后,表型与TFAP2C缺失一致,验证了其下游关系。
研究人员最终揭示了一个精密的“分子刹车”系统:IGF2BP1作为“扫码器”识别m6A修饰,激活OTX2“刹车片”,而OTX2并非直接调控基因表达,而是通过干扰促进生殖细胞发育的蛋白TFAP2C发挥作用。进一步研究发现,OTX2、TFAP2C和MacroH2A.1三个蛋白会形成稳定的复合物。在正常情况下,三者紧密结合,限制生殖细胞过度发育;而当OTX2缺失时,复合物稳定性降低,MacroH2A.1与TFAP2C的结合减弱,导致生殖细胞数量激增。
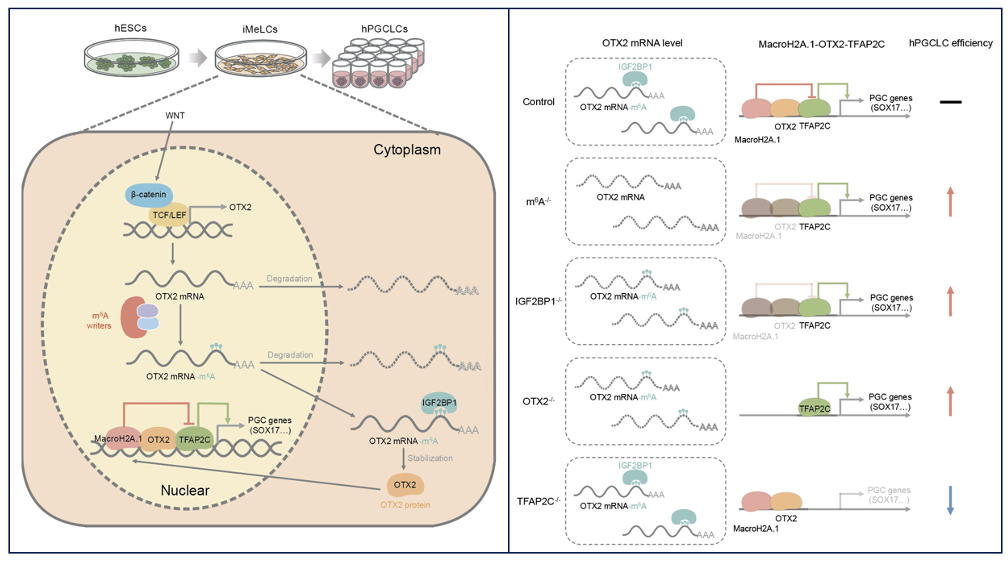
在本研究中,研究人员揭示了m6A-IGF2BP1-OTX2-MacroH2A.1-TFAP2C信号轴,该通路通过多级级联反应精确调控原始生殖细胞的发育进程,确保生殖细胞谱系的正常形成。与此同时,该研究还揭示了表观转录组与生殖细胞特化的直接关联,拓展了表观转录调控在发育生物学中作用的理解,揭示mRNA修饰可以通过多层级分子网络精确调控细胞命运决定,成为维持体细胞稳定性的重要表观遗传屏障。这一重大发现不仅帮助我们理解身体是如何控制生殖细胞的产生数量,同时为生育力相关疾病的分子诊断和生殖干预提供了新靶点,增进了对人生殖发育的认识,有望为生育力低下等生殖健康问题提供新的治疗途径。

该论文的共同第一作者为浙江大学爱丁堡大学联合学院博士生张晋、古雅诗和童玲玲。共同通讯作者包括浙江大学爱丁堡大学联合学院陈迪博士、中山大学肿瘤防治中心黄慧琳博士及浙江大学医学院梁洪青博士。该研究得到了国家自然科学基金、浙江省自然科学基金及科技部等项目的资助。







